Legen Sie eine PCR-Experiment-SOP fest, um das Verhalten des Experimentierpersonals zu standardisieren.

Der Experimentator hält sich strikt an die Betriebsabläufe und minimiert die PCR-Verschmutzung, die durch menschliche Faktoren verursacht werden kann, oder verhindert das Auftreten von Verschmutzungen.Darüber hinaus sollte der Experimentator über die entsprechenden Fachkenntnisse und Fähigkeiten verfügen, einschließlich der Beherrschung der zugehörigen Geräte, der Klärung des gesamten Arbeitsprozesses, der Beherrschung der Behandlungsmethoden von Kontaminationen und der Methoden der Laborqualitätskontrolle sowie der Fähigkeit, die Testergebnisse richtig zu interpretieren.
Richten Sie ein Standard-PCR-Labor ein.

Das PCR-Labor ist im Prinzip in vier Bereiche unterteilt: Reagenzienvorbereitungsbereich, Probenverarbeitungsbereich, Amplifikationsbereich und Amplifikationsproduktanalysebereich.Die ersten beiden Bereiche sind Vorverstärkungsbereiche und die letzten beiden Bereiche sind Nachverstärkungsbereiche.Die Vorverstärkungszone und die Nachverstärkungszone sollten strikt getrennt sein.Experimentelle Materialien, Reagenzien, Aufzeichnungspapier, Stifte, Reinigungsmaterialien usw. dürfen nur vom Vorverstärkungsbereich zum Nachverstärkungsbereich, d. h. vom Reagenzienvorbereitungsbereich → Probenverarbeitungsbereich → Amplifikationsbereich → Amplifikationsproduktanalysebereich, fließen und dürfen nicht zurückfließen.Der Luftstrom im Labor sollte auch vom Vorverstärkungsbereich zum Nachverstärkungsbereich fließen und nicht rückwärts strömen.Das ideale PCR-Labordesign ist unten dargestellt:
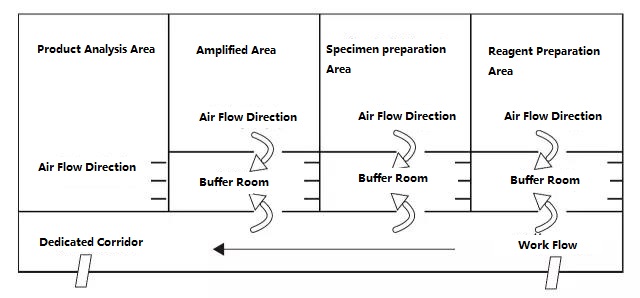
Abbildung A: Idealer PCR-Labor-Setup-Modus mit Unterdruck im Pufferraum
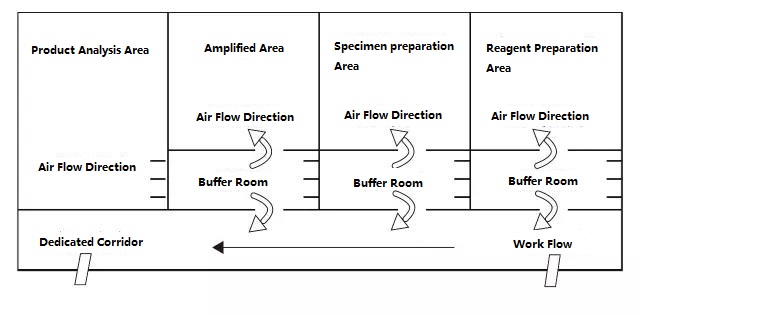
Abbildung B: Idealer PCR-Labor-Setup-Modus mit Überdruck im Pufferraum
Die in Abbildung A und Abbildung B dargestellten PCR-Labor-Setup-Diagramme dürften einen idealeren Setup-Modus darstellen, und das Labor mit den entsprechenden Bedingungen kann sich bei der Planung auf diesen Modus beziehen.Für normale Labore wird empfohlen, den PCR-Amplifikationsbereich und den Produktanalysebereich zu trennen und die Öffnung der Abdeckung im Probenvorbereitungsbereich und im PCR-Amplifikationsbereich so weit wie möglich zu reduzieren.Denken Sie daran: Es ist strengstens verboten, Produkte und Versuchsmaterialien aus dem Produktanalysebereich in den Probenvorbereitungsbereich und den PCR-Amplifikationsbereich mitzunehmen.

Wenn das Labor nur PCR-Nachweis und -Identifizierung durchführt, wird empfohlen, anstelle der herkömmlichen PCR die quantitative Fluoreszenz-PCR zu verwenden.
Quantitative Fluoreszenz-PCR-Nachweisergebnisse können anhand von Fluoreszenzsignalen gesammelt und analysiert werden, so dass nach der Reaktion der Deckel für die Elektrophorese nicht geöffnet werden muss, wodurch eine Kontamination des PCR-Produkts durch das Austreten von Reaktionsprodukten und die Bildung von Aerosolen vermieden wird.Wenn Sie während des Ladeschritts der Gelelektrophorese die Anzahl der Kappenöffnungen erhöhen, ist eine Aerosolkontamination wahrscheinlich.Es wird empfohlen, die Anwendung der quantitativen PCR zu fördern und die qualitative PCR schrittweise zu ersetzen.
Für die PCR-Reaktion wird das UNG Anti-PCR-Produktkontaminationssystem verwendet.
Das System verwendet dUTP anstelle von dTTP.Nach der PCR-Reaktion werden alle PCR-Produkte (DNA-Fragmente) mit dUTP eingebaut;In der nächsten Runde der PCR-Reaktion wird das dem System hinzugefügte UNG-Enzym vor der PCR 5 Minuten lang bei 37 °C inkubiert, wodurch alle DNA-Fragmente, die dUTP enthalten, spezifisch abgebaut werden können, und dann wird eine PCR-Reaktion durchgeführt.Dadurch kann die durch PCR-Produkte verursachte Aerosolkontamination vollständig entfernt werden.Der Effekt ist in der folgenden Abbildung dargestellt:
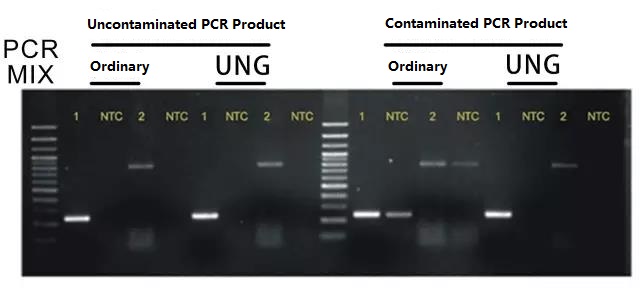
Hinweis: Für die direkte PCR-Serie können Sie die Serienprodukte des Anti-PCR-Produktkontaminationssystems von Foregene wählenEmpfehlen
Für Labore, die groß angelegte Genotypisierungstests durchführen, wird dringend empfohlen, neben dem Bau angemessener Labore auch das UNG-Anti-PCR-Produktkontaminationssystem zum Testen von Reagenzien zu verwenden.
Zur Erinnerung: Der Einsatz dieses Systems kann die bereits entstandene PCR-Produktkontamination nicht beseitigen.Daher sollte das UNG-System zu Beginn des entsprechenden Tests verwendet werden und das UNG-System sollte für die PCR-Amplifikation verwendet werden, um eine Kontamination falsch positiver PCR-Produkte zu verhindern.
Es wird empfohlen, das Direct PCR-UNG-System von Foregene zu verwenden, wenn Sie groß angelegte Tests durchführen, wie zum Beispiel:
Direktes PCR-Kit für Pflanzenblätter-UNG;
Pflanzensamen-Direkt-PCR-Kit-UNG;
Tiergewebe-Direkt-PCR-Kit-UNG;
Mouse Tail Direct PCR Kit-UNG;
Zebra Fish Direct PCR Kit-UNG.
Diese Bausatzserie von Foregenekann nicht nur den PCR-Nachweis schnell und in großem Maßstab durchführen, sondern auch die Kontamination von PCR-Produkten wirksam verhindern und kontrollieren.
Zeitpunkt der Veröffentlichung: 19. März 2021








