Mit der kontinuierlichen Weiterentwicklung der molekularbiologischen Technologie hat der Zusammenhang zwischen Genmutationen und -defekten und Krankheiten ein immer tiefergehendes Verständnis gewonnen.Nukleinsäuren haben aufgrund ihres großen Anwendungspotenzials bei der Diagnose und Behandlung von Krankheiten große Aufmerksamkeit auf sich gezogen.Nukleinsäure-Medikamente beziehen sich auf künstlich synthetisierte DNA- oder RNA-Fragmente mit Funktionen zur Behandlung von Krankheiten.Solche Medikamente können direkt auf krankheitsverursachende Zielgene oder krankheitsverursachende Ziel-mRNAs einwirken und bei der Behandlung von Krankheiten auf Genebene eine Rolle spielen.Im Vergleich zu herkömmlichen niedermolekularen Medikamenten und Antikörpermedikamenten können Nukleinsäuremedikamente die Expression krankheitsverursachender Gene von der Wurzel aus regulieren und haben die Eigenschaften, „die Symptome zu behandeln und die Grundursache zu heilen“.Nukleinsäuremedikamente haben auch offensichtliche Vorteile wie hohe Effizienz, geringe Toxizität und hohe Spezifität.Seit der Einführung des ersten Nukleinsäure-Medikaments Fomivirsen-Natrium im Jahr 1998 wurden viele Nukleinsäure-Medikamente für die klinische Behandlung zugelassen.
Zu den derzeit weltweit auf dem Markt befindlichen Nukleinsäure-Medikamenten gehören hauptsächlich Antisense-Nukleinsäure (ASO), Small Interfering RNA (siRNA) und Nukleinsäure-Aptamer.Mit Ausnahme von Nukleinsäure-Aptameren (die 30 Nukleotide überschreiten können) handelt es sich bei Nukleinsäure-Arzneimitteln in der Regel um Oligonukleotide, die aus 12 bis 30 Nukleotiden bestehen und auch als Oligonukleotid-Arzneimittel bezeichnet werden.Darüber hinaus haben miRNAs, Ribozyme und Desoxyribozyme auch einen großen Entwicklungswert bei der Behandlung verschiedener Krankheiten gezeigt.Nukleinsäure-Medikamente sind heute zu einem der vielversprechendsten Bereiche in der Forschung und Entwicklung der Biomedizin geworden.
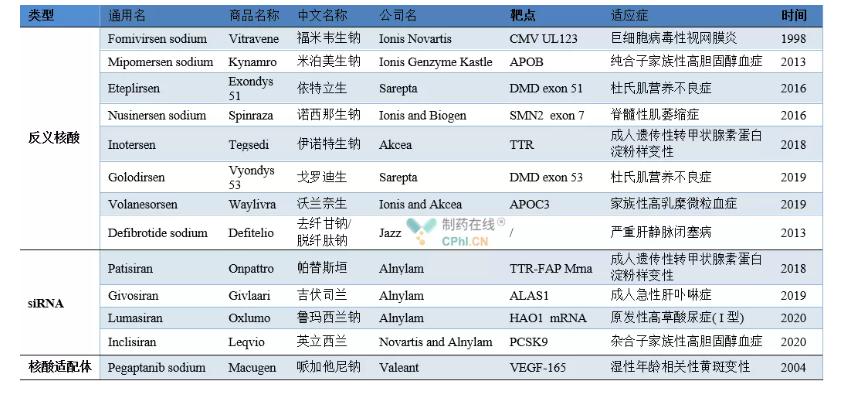
Beispiele für zugelassene Nukleinsäure-Medikamente
Antisense-Nukleinsäure
Die Antisense-Technologie ist eine neue Arzneimittelentwicklungstechnologie, die auf dem Prinzip der Watson-Crick-Basenkomplementierung basiert und spezifische komplementäre DNA- oder RNA-Fragmente verwendet, die künstlich synthetisiert oder vom Organismus synthetisiert werden, um die Expression von Zielgenen gezielt zu regulieren.Die Antisense-Nukleinsäure weist eine zur Ziel-RNA komplementäre Basensequenz auf und kann spezifisch an diese binden.Antisense-Nukleinsäuren umfassen im Allgemeinen Antisense-DNA, Antisense-RNA und Ribozyme.Unter diesen nimmt Antisense-DNA aufgrund der hohen Stabilität und der geringen Kosten von Antisense-DNA eine dominierende Stellung in der aktuellen Forschung und Anwendung von Antisense-Nukleinsäure-Arzneimitteln ein.
Fomivirsen-Natrium (Handelsname Vitravene) wurde von Ionis Novartis entwickelt.Im August 1998 erteilte die FDA die Zulassung für die Behandlung der Zytomegalievirus-Retinitis bei immungeschwächten Patienten (hauptsächlich AIDS-Patienten) und war damit das erste Nukleinsäuremedikament, das auf den Markt kam.Fomivirsen hemmt die teilweise Proteinexpression von CMV durch Bindung an spezifische mRNA (IE2) und reguliert so die Expression viraler Gene, um therapeutische Wirkungen zu erzielen.Aufgrund des Aufkommens einer hochwirksamen antiretroviralen Therapie, die die Zahl der Patienten stark reduziert hat, hat Novartis jedoch 2002 und 2006 die Marktzulassung von Fomivirsen-Arzneimitteln in Europa bzw. den Vereinigten Staaten widerrufen und das Produkt wurde vom Markt genommen.
Mipomersen-Natrium (Handelsname Kynamro) ist ein ASO-Medikament, das von der französischen Firma Genzyme entwickelt wurde.Im Januar 2013 hat die FDA es für die Behandlung homozygoter familiärer Hypercholesterinämie zugelassen.Mipomersen hemmt die Expression des ApoB-100-Proteins (Apolipoprotein) durch Bindung an ApoB-100mRNA und senkt dadurch das menschliche Low-Density-Lipoprotein-Cholesterin, Low-Density-Lipoprotein und andere Indikatoren erheblich, jedoch aufgrund von Nebenwirkungen wie Lebertoxizität, 13. Dezember 2012. Am selben Tag lehnte die EMA auch den Antrag auf eine Verkaufslizenz für das Medikament ab.
Im September 2016 wurde Eteplirsen (Handelsname Exon 51), das von Sarepta zur Behandlung der Duchenne-Muskeldystrophie (DMD) entwickelt wurde, von der FDA zugelassen.DMD-Patienten können aufgrund von Mutationen im DMD-Gen im Körper normalerweise kein funktionelles antiatrophisches Protein exprimieren.Eteplirsen bindet spezifisch an Exon 51 der Prä-Messenger-RNA (Pre-mRNA) des Proteins, entfernt Exon 51 und stellt die normale Expression, Transkription und Translation einiger Downstream-Gene wieder her, um einen Teil von Dystrophin zu erhalten und so die therapeutische Wirkung zu erzielen.
Nusinersen ist ein von Spinraza entwickeltes ASO-Medikament zur Behandlung von spinaler Muskelatrophie und wurde am 23. Dezember 2016 von der FDA zugelassen. Im Jahr 2018 wurde Inotesen von Tegsedi zur Behandlung der erblichen Transthyretin-Amyloidose bei Erwachsenen von der FDA zugelassen.Im Jahr 2019 wurde Golodirsen, das von Sarepta zur Behandlung der Duchenne-Muskeldystrophie entwickelt wurde, von der FDA zugelassen.Es hat den gleichen Wirkmechanismus wie Eteplirsen und sein Wirkort wird Exon 53. Im selben Jahr wurde Volanesorsen, das gemeinsam von Ionis und Akcea zur Behandlung familiärer Hyperchylomikronämie entwickelt wurde, von der Europäischen Arzneimittel-Agentur (EMA) zugelassen.Volanesorsen reguliert den Triglyceridstoffwechsel, indem es die Produktion von Apolipoprotein C-Ⅲ hemmt, hat aber auch den Nebeneffekt, dass es die Blutplättchenzahl senkt.
Defibrotid ist eine von Jazz entwickelte Oligonukleotidmischung mit Plasmineigenschaften.Es enthält 90 % einzelsträngige DNA und 10 % doppelsträngige DNA.Es wurde 2013 von der EMA und anschließend von der FDA für die Behandlung schwerer Lebervenen zugelassen.Verschlusskrankheit.Defibrotid kann die Aktivität von Plasmin erhöhen, den Plasminogenaktivator erhöhen, die Hochregulierung von Thrombomodulin fördern und die Expression von Von-Willebrand-Faktor und Plasminogenaktivator-Inhibitoren reduzieren, um therapeutische Wirkungen zu erzielen
siRNA
siRNA ist ein kleines RNA-Fragment mit einer bestimmten Länge und Sequenz, das durch Schneiden der Ziel-RNA entsteht.Diese siRNAs können gezielt den Abbau der Ziel-mRNA induzieren und Gen-Silencing-Effekte erzielen.Im Vergleich zu chemischen Arzneimitteln mit kleinen Molekülen weist der Gen-Silencing-Effekt von siRNA-Arzneimitteln eine hohe Spezifität und Effizienz auf.
Am 11. August 2018 wurde das erste siRNA-Medikament Patisiran (Handelsname Onpattro) von der FDA zugelassen und offiziell auf den Markt gebracht.Dies ist einer der wichtigsten Meilensteine in der Entwicklungsgeschichte der RNA-Interferenztechnologie.Patisiran wurde gemeinsam von Alnylam und Genzyme, einer Tochtergesellschaft von Sanofi, entwickelt.Es handelt sich um ein siRNA-Medikament zur Behandlung der erblichen Thyroxin-vermittelten Amyloidose.Im Jahr 2019 wurde Givosiran (Handelsname Givlaari) von der FDA als zweites siRNA-Medikament zur Behandlung der akuten hepatischen Porphyrie bei Erwachsenen zugelassen.Im Jahr 2020 entwickelte Alnylam ein primäres Typ-I-Medikament zur Behandlung von Kindern und Erwachsenen.Lumasiran mit hoher Oxalurie wurde von der FDA zugelassen.Im Dezember 2020 wurde Inclisiran, das gemeinsam von Novartis und Alnylam zur Behandlung von Hypercholesterinämie oder gemischter Dyslipidämie bei Erwachsenen entwickelt wurde, von der EMA zugelassen.
Aptamer
Nukleinsäureaptamere sind Oligonukleotide, die mit hoher Affinität und Spezifität an eine Vielzahl von Zielmolekülen wie kleine organische Moleküle, DNA, RNA, Polypeptide oder Proteine binden können.Im Vergleich zu Antikörpern zeichnen sich Nukleinsäureaptamere durch einfache Synthese, geringere Kosten und ein breites Spektrum an Zielen aus und bieten ein größeres Potenzial für die Arzneimittelanwendung bei der Diagnose, Behandlung und Prävention von Krankheiten.
Pegaptanib ist das erste von Valeant entwickelte Nukleinsäure-Aptamer-Medikament zur Behandlung der feuchten altersbedingten Makuladegeneration und wurde 2004 von der FDA zugelassen. Anschließend wurde es im Januar 2006 und Juli 2008 von der EMA und der PMDA zugelassen und kam auf den Markt.Pegaptanib hemmt die Angiogenese durch die Kombination von räumlicher Struktur und vaskulärem endothelialen Wachstumsfaktor, um therapeutische Wirkungen zu erzielen.Seitdem ist das Unternehmen auf Konkurrenz durch ähnliche Medikamente wie Lucentis gestoßen und sein Marktanteil ist stark zurückgegangen.
Nukleinsäure-Arzneimittel sind aufgrund ihrer bemerkenswerten Heilwirkung und kurzen Entwicklungszyklen zu einem Hotspot auf dem Markt für klinische Arzneimittel und neue Arzneimittel geworden.Als aufstrebendes Medikament steht es vor Herausforderungen und bietet gleichzeitig Chancen.Aufgrund ihrer exogenen Eigenschaften sind die Spezifität, Stabilität und effektive Abgabe von Nukleinsäuren zu den Hauptkriterien für die Beurteilung geworden, ob Oligonukleotide zu hochwirksamen Nukleinsäure-Arzneimitteln werden können.Off-Target-Effekte waren schon immer ein zentraler Punkt bei Nukleinsäure-Medikamenten, der nicht ignoriert werden kann.Nukleinsäuremedikamente können jedoch die Expression krankheitsverursachender Gene aus der Wurzel beeinflussen und eine Sequenzspezifität auf Einzelbasenebene erreichen, was die Eigenschaften hat, „die Grundursache zu behandeln und die Symptome zu behandeln“.Angesichts der Variabilität von immer mehr Krankheiten kann nur eine genetische Behandlung dauerhafte Ergebnisse erzielen.Mit der kontinuierlichen Verbesserung, Perfektionierung und dem Fortschritt verwandter Technologien werden Nukleinsäuremedikamente, repräsentiert durch Antisense-Nukleinsäuren, siRNA und Nukleinsäureaptamere, mit Sicherheit eine neue Welle in der Krankheitsbehandlung und in der Pharmaindustrie auslösen.
RReferenzen:
[1] Liu Shaojin, Feng Xuejiao, Wang Junshu, Xiao Zhengqiang, Cheng Pingsheng.Marktanalyse von Nukleinsäuremedikamenten in meinem Land und Gegenmaßnahmen[J].Chinese Journal of Biological Engineering, 2021, 41(07): 99-109.
[2] Chen Wenfei, Wu Fuhua, Zhang Zhirong, Sun Xun.Forschungsfortschritte in der Pharmakologie vermarkteter Nukleinsäure-Arzneimittel[J].Chinese Journal of Pharmaceuticals, 2020, 51(12): 1487-1496.
[3] Wang Jun, Wang Lan, Lu Jiazhen, Huang Zhen.Analyse der Wirksamkeit und des Forschungsfortschritts vermarkteter Nukleinsäure-Medikamente[J].Chinese Journal of New Drugs, 2019, 28(18): 2217-2224.
Über den Autor: Sha Luo, ein Forschungs- und Entwicklungsmitarbeiter für chinesische Medizin, arbeitet derzeit für ein großes inländisches Arzneimittelforschungs- und -entwicklungsunternehmen und engagiert sich für die Forschung und Entwicklung neuer chinesischer Arzneimittel.
Verwandte Produkte:
Zeitpunkt der Veröffentlichung: 19. November 2021