Die Überprüfung der Leistung von Primern und Sonden im Frühstadium von PCR-Reagenzien und die Bestimmung der am besten geeigneten Reaktionsbedingungen sind die Voraussetzungen, um den reibungslosen Ablauf formaler Experimente sicherzustellen.
Wie müssen wir also die Primersonde im Frühstadium bestätigen?
Die Hauptindikatoren sind Basislinie, Amplifikationskurve, CT-Wert, Amplifikationseffizienz, Erkennung von Proben mit niedriger Konzentration, CV usw.
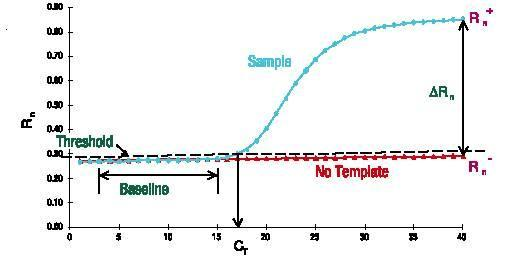
Grundlinie
Die Basislinie ist die horizontale Linie in der PCR-Amplifikationskurve.In den ersten Zyklen der PCR-Amplifikationsreaktion ändert sich das Fluoreszenzsignal kaum und bildet eine gerade Linie.Diese Gerade ist die Grundlinie.
Achten Sie beim Screening von PCR-Primersonden darauf, ob die Grundlinie eben ist.Die Reinheit der Primersondenkonzentration wirkt sich auf die Basislinie aus und führt beispielsweise zu einem Anstieg oder Abfall der Basislinie.Die Grundlinie ist auch ein sehr intuitiver Indikator.
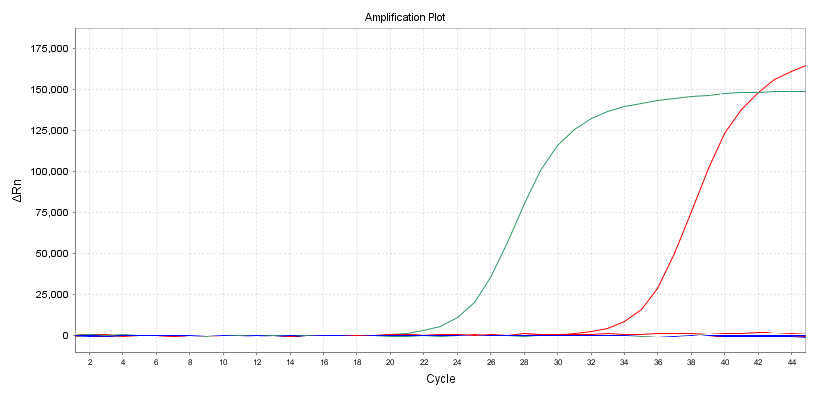
Verstärkungskurve
Ein weiterer intuitiver Indikator ist die Form der Verstärkungskurve.Am besten ist eine S-förmige Kurve, um eine Sekundärverstärkung oder andere abnormale Verstärkungskurven zu vermeiden.
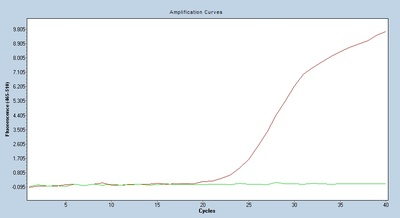
Ct-Wert
Die Anzahl der Zyklen, die dem Wendepunkt von der Grundlinie bis zum exponentiellen Wachstum entsprechen, ist der Ct-Wert.
Für dieselbe Probe führen unterschiedliche Primersonden zu unterschiedlichen Amplifikationskurven, und der entsprechende Ct-Wert wird durch die Amplifikationseffizienz und den Interferenzgrad beeinflusst.Theoretisch ist es umso besser, je kleiner der Ct-Wert der von uns gewählten Primersonde ist.
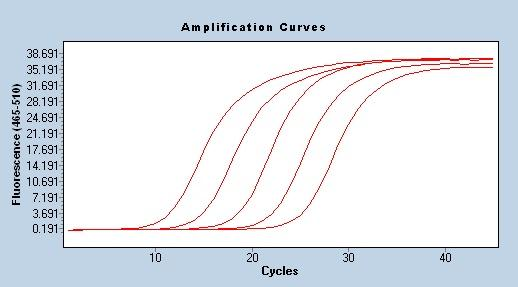
Verstärkungseffizienz
Eine der zuverlässigsten und stabilsten Methoden zur Bewertung der PCR-Amplifikationseffizienz ist die Standardkurve, die auch von Forschern weithin anerkannt wird.Die Methode umfasst die Erstellung einer Reihe von Stichproben, um die relative Anzahl der Zielvorlagen zu kontrollieren.Diese Proben werden normalerweise durch Reihenverdünnung konzentrierter Stammlösungen hergestellt, am häufigsten wird eine 10-fache Verdünnung verwendet.Verwenden Sie eine Reihe verdünnter Proben, verwenden Sie ein Standard-qPCR-Programm zur Amplifikation, um den Cq-Wert zu erhalten, und zeichnen Sie schließlich eine Standardkurve entsprechend der Konzentration jeder Probe und dem entsprechenden Cq-Wert, um die lineare Gleichung Cq= -klgX0+b und die Amplifikationseffizienz E=10(-1 /k)-1 zu erhalten.Bei der Verwendung von qPCR für die quantitative Analyse muss die Amplifikationseffizienz im Bereich von 90 % bis 110 % liegen (3,6 > k > 3,1).
Erkennung von Proben mit geringer Konzentration
Wenn die Probenkonzentration niedrig ist, sind die Erkennungsraten verschiedener Primersonden unterschiedlich.Wir wählen 20 Proben mit niedriger Konzentration zur Replikation aus, und das Primer-Sonden-System mit der höchsten Erkennungsrate ist das beste.
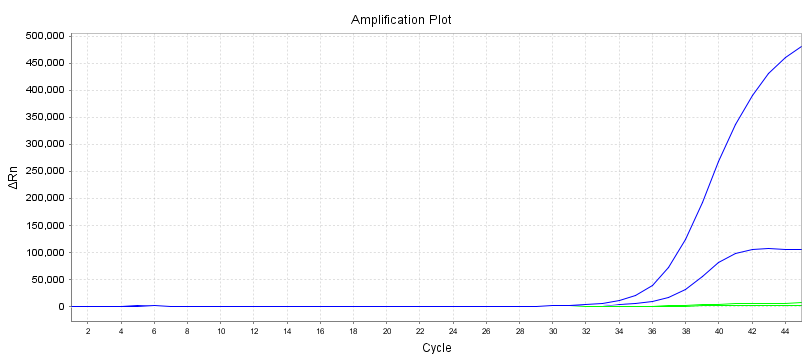
Variationskoeffizient (CV)
10 doppelte Proben können mit unterschiedlichen Primersonden entsprechend dem Linienstandard des Reagenzes für den Nachweis der Nukleinsäureamplifikation nachgewiesen werden.
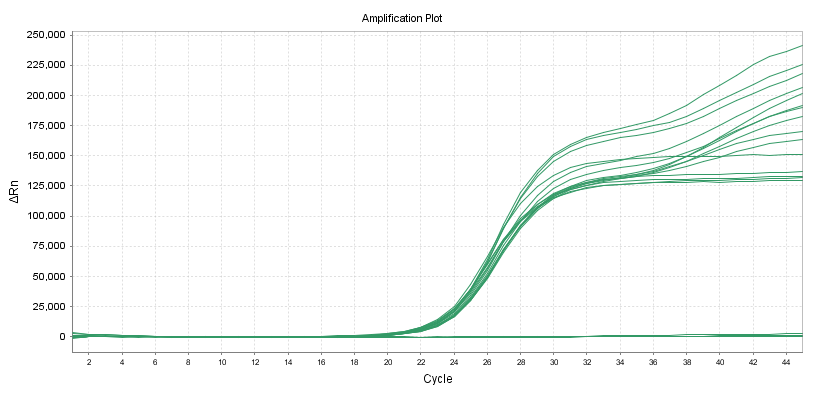
Quantitative Reagenzien:
Genauigkeit
Die Genauigkeit innerhalb einer Charge sollte Folgendes erfüllen: Der Variationskoeffizient (CV, %) des logarithmischen Werts der Testkonzentration beträgt ≤5 %.Wenn die Probenkonzentration niedrig ist, beträgt der Variationskoeffizient (CV, %) des Logarithmus der Nachweiskonzentration ≤10 %
Qualitative Reagenzien:
Genauigkeit
Die Genauigkeit innerhalb einer Charge sollte Folgendes erfüllen:
(1) Variationskoeffizient des Ct-Werts (CV, %) ≤5 %
Dieselbe Probe wird zehnmal parallel getestet und die Testergebnisse sollten konsistent sein
Zeitpunkt der Veröffentlichung: 18.09.2021








