Der Ct-Wert ist die wichtigste Ergebnisdarstellungsform der fluoreszierenden quantitativen PCR.Es wird verwendet, um Unterschiede in der Genexpression oder die Anzahl der Genkopien zu berechnen.Welcher Ct-Wert der Fluoreszenzquantifizierung wird also als angemessen angesehen?Wie kann der effektive Bereich des Ct-Werts sichergestellt werden?
Was ist der Ct-Wert?
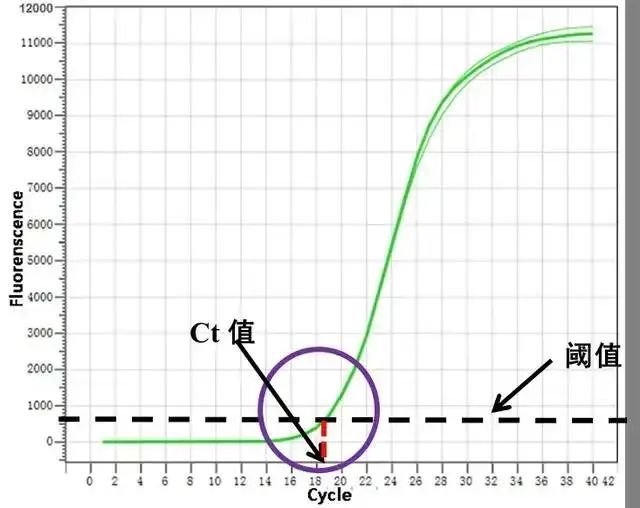
Während des qPCR-Amplifikationsprozesses erfolgt die entsprechende Anzahl von Amplifikationszyklen (Zyklusschwelle), wenn das Fluoreszenzsignal des amplifizierten Produkts den eingestellten Fluoreszenzschwellenwert erreicht.C steht für Cycle und T steht für Threshold.Einfach ausgedrückt ist der Ct-Wert die Anzahl der Zyklen, die dem Zeitpunkt entspricht, an dem die anfängliche Template-Amplifikation eine bestimmte Produktmenge in der qPCR erreicht.Die sogenannte „bestimmte Produktmenge“ wird später näher erläutert.
Was bewirkt der Ct-Wert?
1.Beziehung zwischen exponentieller Verstärkung, Template-Menge und Ct-Wert
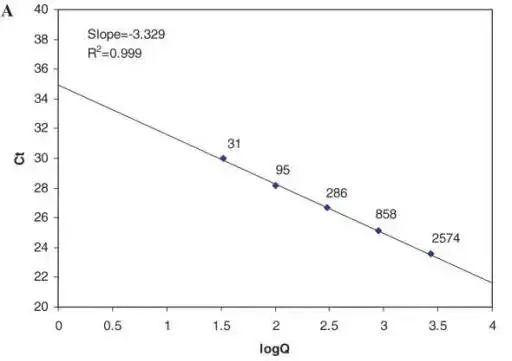
Im Idealfall werden Gene in der qPCR nach einer bestimmten Anzahl von Zyklen durch exponentielle Amplifikation akkumuliert.Die Beziehung zwischen der Anzahl der Amplifikationszyklen und der Menge der Produkte ist: Amplifizierte Produktmenge = anfängliche Template-Menge × (1+En) Zyklenzahl.Allerdings ist die qPCR-Reaktion nicht immer in einem idealen Zustand.Wenn die Menge des amplifizierten Produkts eine „bestimmte Produktmenge“ erreicht, entspricht die Anzahl der Zyklen zu diesem Zeitpunkt dem Ct-Wert und liegt in der exponentiellen Amplifikationsperiode.Die Beziehung zwischen dem Ct-Wert und der Menge der Startvorlage: Es besteht eine lineare Beziehung zwischen dem Ct-Wert der Vorlage und dem Logarithmus der Startkopiennummer der Vorlage.Je höher die anfängliche Templatkonzentration, desto kleiner ist der Ct-Wert;Je niedriger die anfängliche Templatkonzentration ist, desto größer ist der Ct-Wert.
2.Amplifikationskurve, Fluoreszenzschwelle und bestimmte PCR-Produktmenge
Die Menge des qPCR-Amplifikationsprodukts wird direkt in Form eines Fluoreszenzsignals, also der Amplifikationskurve, dargestellt.Im frühen Stadium der PCR findet die Amplifikation unter idealen Bedingungen statt, die Anzahl der Zyklen ist gering, die Produktakkumulation ist gering und der Fluoreszenzpegel kann nicht klar vom Fluoreszenzhintergrund unterschieden werden.Danach nimmt die Fluoreszenz zu und tritt in die exponentielle Phase ein.Zu einem bestimmten Zeitpunkt, wenn sich die PCR-Reaktion gerade in der exponentiellen Phase befindet, kann die Menge an PCR-Produkt erfasst werden, die als „eine bestimmte Produktmenge“ verwendet werden kann, und daraus kann auf den anfänglichen Inhalt der Vorlage geschlossen werden.Daher ist die Fluoreszenzsignalintensität, die einer bestimmten Produktmenge entspricht, der Fluoreszenzschwellenwert.
Im Spätstadium der PCR zeigt die Amplifikationskurve keine exponentielle Amplifikation mehr und geht in die lineare Phase und die Plateauphase über.
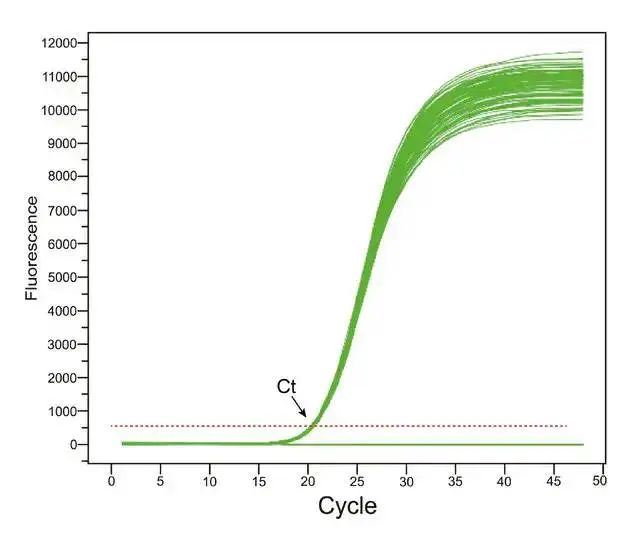
3.Reproduzierbarkeit der Ct-Werte
Wenn der PCR-Zyklus die Zyklusnummer des Ct-Werts erreicht, ist er gerade in die wahre exponentielle Amplifikationsperiode eingetreten.Zu diesem Zeitpunkt wurde der kleine Fehler nicht verstärkt, so dass die Reproduzierbarkeit des Ct-Werts ausgezeichnet ist, d. h. die gleiche Vorlage wird zu unterschiedlichen Zeiten oder in verschiedenen Röhrchen gleichzeitig verstärkt.Verstärkung ist der erhaltene Ct-Wert konstant.
1.Verstärkungseffizienz En
Unter PCR-Amplifikationseffizienz versteht man die Effizienz, mit der die Polymerase das zu amplifizierende Gen in ein Amplifikat umwandelt.Die Amplifikationseffizienz bei der Umwandlung eines DNA-Moleküls in zwei DNA-Moleküle beträgt 100 %.Die Verstärkungseffizienz wird üblicherweise als En ausgedrückt.Um die Analyse nachfolgender Artikel zu erleichtern, werden die Faktoren, die die Verstärkungseffizienz beeinflussen, kurz vorgestellt.
| Beeinflussende Faktoren | Erläuterung | Wie urteilen? |
| A. PCR-Inhibitoren | 1. Die Template-DNA enthält Substanzen, die die PCR-Reaktion hemmen, wie zum Beispiel Proteine oder Detergenzien.2. Die cDNA nach der reversen Transkription enthält eine hohe Konzentration an Template-RNA- oder RT-Reagenzkomponenten, die auch die nachfolgende PCR-Reaktion hemmen können. | 1. Ob eine Verschmutzung vorliegt, kann durch Messung des Verhältnisses von A260/A280 und A260/A230 oder durch RNA-Elektrophorese beurteilt werden.2. Ob die cDNA nach der reversen Transkription in einem bestimmten Verhältnis verdünnt wird. |
| B. Falsches Primer-Design | Primer lassen sich nicht effizient anlagern | Überprüfen Sie die Primer auf Primer-Dimere oder Haarnadeln, Fehlpaarungen und manchmal übergreifende intronische Designs. |
| C. Unsachgemäßes Design des PCR-Reaktionsprogramms | 1. Primer können nicht effektiv ausheilen2. Unzureichende Freisetzung von DNA-Polymerase 3. Langfristige Hochtemperatur-DNA-Polymeraseaktivität nahm ab | 1. Die Glühtemperatur ist höher als der TM-Wert des Primers2. Die Zeit vor der Denaturierung ist zu kurz 3. Die Dauer jeder Stufe des Reaktionsverfahrens ist zu lang |
| D. Unzureichendes Mischen der Reagenzien oder Pipettierfehler | Im Reaktionssystem ist die lokale Konzentration der PCR-Reaktionskomponenten zu hoch oder ungleichmäßig, was zu einer nicht-exponentiellen Amplifikation der PCR-Amplifikation führt | |
| E. Amplikonlänge | Die Länge des Amplifikats ist zu lang (über 300 bp) und die Amplifikationseffizienz ist gering | Überprüfen Sie, ob die Amplikonlänge zwischen 80 und 300 bp liegt |
| F. Einfluss von qPCR-Reagenzien | Die Konzentration der DNA-Polymerase im Reagenz ist niedrig oder die Ionenkonzentration im Puffer ist nicht optimiert, was dazu führt, dass die Taq-Enzymaktivität nicht das Maximum erreicht | Bestimmung der Verstärkungseffizienz anhand der Standardkurve |
2. Bereich der Ct-Werte
Die Ct-Werte liegen zwischen 15 und 35.Wenn der Ct-Wert weniger als 15 beträgt, wird davon ausgegangen, dass die Amplifikation im Bereich der Basisperiode liegt und die Fluoreszenzschwelle nicht erreicht wurde.Idealerweise besteht ein linearer Zusammenhang zwischen dem Ct-Wert und dem Logarithmus der anfänglichen Kopienzahl der Vorlage, also der Standardkurve.Gemäß der Standardkurve liegt der berechnete Ct-Wert zur Quantifizierung der Einzelkopienzahl des Gens bei einer Amplifikationseffizienz von 100 % bei etwa 35. Wenn er größer als 35 ist, ist die anfängliche Kopienzahl der Vorlage theoretisch kleiner als 1, was als bedeutungslos angesehen werden kann.
Für unterschiedliche Gen-Ct-Bereiche ist es aufgrund der unterschiedlichen Genkopienzahl und der Amplifikationseffizienz in der anfänglichen Matrizenmenge erforderlich, eine Standardkurve für das Gen zu erstellen und den linearen Nachweisbereich des Gens zu berechnen.
3. Einflussfaktoren des Ct-Wertes
Aus der Beziehung zwischen der Anzahl der Amplifikationszyklen und der Produktmenge: Menge des amplifizierten Produkts = Menge des anfänglichen Templates × (1+En)-Zykluszahl lässt sich erkennen, dass unter idealen Bedingungen die Menge des anfänglichen Templates und des En einen negativen Einfluss auf den Ct-Wert hat.Der Unterschied in der Template-Qualität oder der Amplifikationseffizienz führt dazu, dass der Ct-Wert zu groß oder zu klein ist.
4. Der Ct-Wert ist zu groß oder zu klein
Zeitpunkt der Veröffentlichung: 22. Februar 2023