Antikörper, auch Immunglobuline (Ig) genannt, sind Glykoproteine, die spezifisch an Antigene binden.
Herkömmliche Antikörperpräparate werden durch Immunisierung von Tieren und Sammeln von Antiserum hergestellt.Daher enthält Antiserum normalerweise Antikörper gegen andere, nicht verwandte Antigene und andere Proteinkomponenten im Serum.Allgemeine Antigenmoleküle enthalten meist mehrere unterschiedliche Epitope, daher sind herkömmliche Antikörper auch eine Mischung von Antikörpern gegen mehrere unterschiedliche Epitope.Selbst die herkömmlichen Serumantikörper, die gegen dasselbe Epitop gerichtet sind, bestehen immer noch aus heterogenen Antikörpern, die von verschiedenen B-Zellklonen produziert werden.Herkömmliche Serumantikörper werden daher auch als polyklonale Antikörper, kurz polyklonale Antikörper, bezeichnet.
Monoklonaler Antikörper (monoklonaler Antikörper) ist ein äußerst einheitlicher Antikörper, der von einem einzelnen B-Zellklon produziert wird und nur gegen ein bestimmtes Epitop gerichtet ist.Es wird normalerweise durch Hybridom-Technologie hergestellt – die Hybridom-Antikörper-Technologie basiert auf der Zellfusionstechnologie, bei der B-Zellen mit der Fähigkeit zur Sekretion spezifischer Antikörper und Myelomzellen mit unbegrenzter Wachstumskapazität in B-Zell-Hybridome kombiniert werden.Diese Hybridomzelle weist die Eigenschaften einer Elternzelle auf.Es kann sich wie Myelomzellen in vitro unbegrenzt und unsterblich vermehren und spezifische Antikörper wie Milzlymphozyten synthetisieren und absondern.Durch Klonen kann eine monoklonale Linie, die von einer einzelnen Hybridomzelle abgeleitet ist, d. h. eine Hybridomzelllinie, erhalten werden.Bei den von ihm produzierten Antikörpern handelt es sich um hochhomogene Antikörper gegen die gleiche antigene Determinante, also um monoklonale Antikörper.
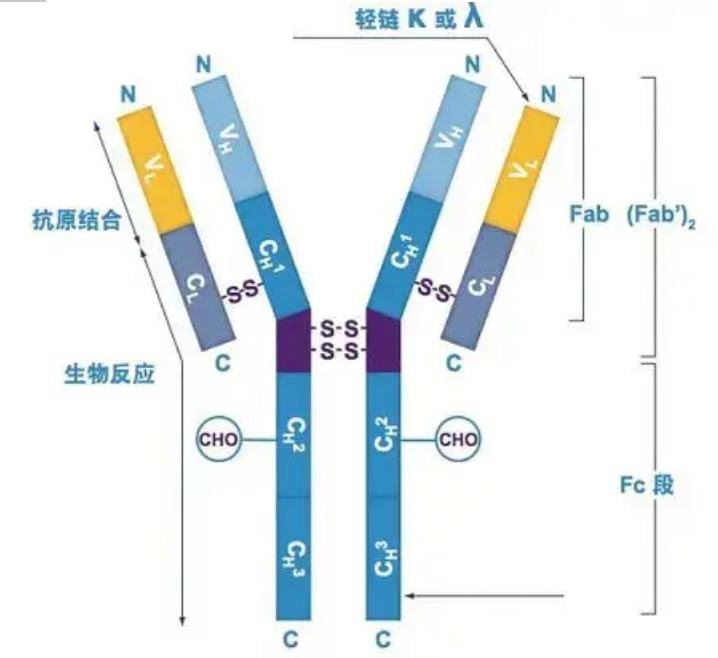
Antikörper liegen als ein oder mehrere Y-förmige Monomere vor (dh monoklonale Antikörper oder polyklonale Antikörper).Jedes Y-förmige Monomer besteht aus 4 Polypeptidketten, darunter zwei identische schwere Ketten und zwei identische leichte Ketten.Leichte und schwere Ketten werden nach ihrem Molekulargewicht benannt.Die Oberseite der Y-förmigen Struktur ist die variable Region, die die Antigenbindungsstelle darstellt.(Auszug aus Detai Bio-Monoclonal Antibody Concept)
Antikörperstruktur
 Schwere Kette
Schwere Kette
Es gibt fünf Arten schwerer Ig-Ketten von Säugetieren, die mit den griechischen Buchstaben α, δ, ε, γ und μ benannt sind.Die entsprechenden Antikörper heißen IgA, IgD, IgE, IgG und IgM.Verschiedene schwere Ketten unterscheiden sich in Größe und Zusammensetzung.α und γ enthalten etwa 450 Aminosäuren, während μ und ε etwa 550 Aminosäuren enthalten.
Jede schwere Kette hat zwei Regionen: die konstante Region und die variable Region.Alle Antikörper desselben Typs haben die gleiche konstante Region, es gibt jedoch Unterschiede zwischen Antikörpern verschiedener Typen.Die konstanten Regionen der schweren Ketten γ, α und δ bestehen aus drei hintereinander angeordneten Ig-Domänen mit einer Gelenkregion zur Erhöhung der Flexibilität;Die konstanten Regionen der schweren Ketten μ und ε bestehen aus 4 Ig-Domänen.Die variable Region der schweren Kette des von verschiedenen B-Zellen produzierten Antikörpers ist unterschiedlich, aber die variable Region des von derselben B-Zelle oder demselben Zellklon produzierten Antikörpers ist dieselbe, und die variable Region jeder schweren Kette ist etwa 110 Aminosäuren lang.Und bilden eine einzelne Ig-Domäne.
Lichterkette
Bei Säugetieren gibt es nur zwei Arten von Leichtketten: den Lambda-Typ und den Kappa-Typ.Jede leichte Kette hat zwei verknüpfte Domänen: eine konstante Region und eine variable Region.Die Länge der leichten Kette beträgt etwa 211–217 Aminosäuren.Die beiden in jedem Antikörper enthaltenen Leichtketten sind immer gleich.Bei Säugetieren hat die leichte Kette in jedem Antikörper nur einen Typ: Kappa oder Lambda.Bei einigen niederen Wirbeltieren, etwa bei Knorpelfischen (Knorpelfischen) und Knochenfischen, kommen auch andere Arten von Leichtketten wie der Iota-Typ (Iota) vor.
Fab- und Fc-Segmente
Das Fc-Segment kann direkt mit Enzymen oder Fluoreszenzfarbstoffen kombiniert werden, um Antikörper zu markieren.Es ist der Teil, an dem der Antikörper während des ELISA-Prozesses auf der Platte verankert wird, und es ist auch der Teil, an dem der zweite Antikörper bei der Immunpräzipitation, dem Immunblotting und der Immunhistochemie erkannt und gebunden wird.Antikörper können durch proteolytische Enzyme wie Papain in zwei F(ab)-Segmente und ein Fc-Segment hydrolysiert werden, oder sie können durch Pepsin aus der Gelenkregion aufgebrochen und in ein F(ab)2-Segment und ein Fc-Segment hydrolysiert werden.IgG-Antikörperfragmente sind manchmal sehr nützlich.Aufgrund des Fehlens des Fc-Segments fällt das F(ab)-Segment nicht mit dem Antigen aus und wird in In-vivo-Studien auch nicht von Immunzellen eingefangen.Aufgrund der kleinen Molekülfragmente und der fehlenden Vernetzungsfunktion (aufgrund des Fehlens des Fc-Segments) wird das Fab-Segment normalerweise zur Radiomarkierung in Funktionsstudien verwendet, und das Fc-Segment wird hauptsächlich als Blockierungsmittel bei der histochemischen Färbung verwendet.
Variable und konstante Regionen
Die variable Region (V-Region) befindet sich bei 1/5 oder 1/4 (enthält etwa 118 Aminosäurereste) der H-Kette in der Nähe des N-Terminus und bei der Hälfte (enthält etwa 108–111 Aminosäurereste) in der Nähe des N-Terminus der L-Kette.Jede V-Region verfügt über einen Peptidring, der durch Disulfidbindungen innerhalb der Kette gebildet wird, und jeder Peptidring enthält etwa 67 bis 75 Aminosäurereste.Die Zusammensetzung und Anordnung der Aminosäuren in der V-Region bestimmen die Antigenbindungsspezifität des Antikörpers.Aufgrund der sich ständig ändernden Arten und Sequenzen der Aminosäuren in der V-Region können viele Arten von Antikörpern mit unterschiedlichen Bindungsantigenspezifitäten gebildet werden.Die V-Regionen der L-Kette und der H-Kette werden VL bzw. VH genannt.Bei VL und VH weisen die Aminosäurezusammensetzung und -sequenz einiger lokaler Regionen einen höheren Variationsgrad auf.Diese Regionen werden hypervariable Regionen (HVR) genannt.Die Aminosäurezusammensetzung und Anordnung der Nicht-HVR-Teile in der V-Region, die als Gerüstregion bezeichnet wird, sind relativ konservativ.Es gibt drei hypervariable Regionen in VL, die sich normalerweise an den Aminosäureresten 24 bis 34 bzw. 89 bis 97 befinden.Die drei HVRs von VL und VH heißen HVR1, HVR2 bzw. HVR3.Die Forschung und Analyse der Röntgenkristallbeugung hat gezeigt, dass die hypervariable Region tatsächlich der Ort ist, an dem das Antikörperantigen bindet, weshalb sie als komplementaritätsbestimmende Region (CDR) bezeichnet wird.Die HVR1, HVR2 und HVR3 von VL und VH können jeweils als CDR1, CDR2 und CDR3 bezeichnet werden.Im Allgemeinen weist CDR3 einen höheren Grad an Hypervariabilität auf.Die hypervariable Region ist auch der Hauptort, an dem die idiotypischen Determinanten von Ig-Molekülen existieren.In den meisten Fällen spielt die H-Kette eine wichtigere Rolle bei der Bindung an das Antigen.
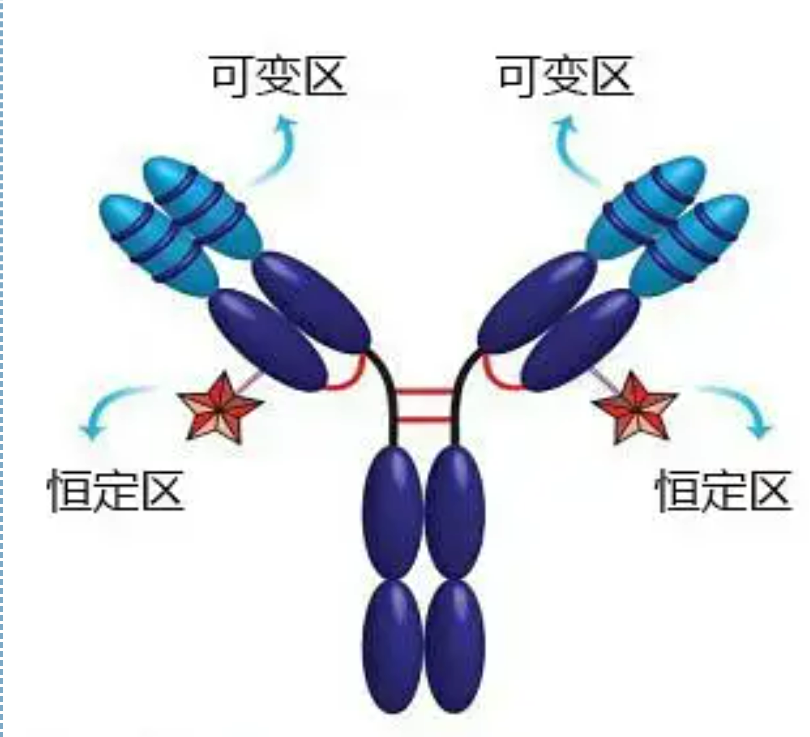 Die konstante Region (C-Region)befindet sich bei 3/4 oder 4/5 (ungefähr von Aminosäure 119 bis zum C-Terminus) der H-Kette in der Nähe des C-Terminus und bei der Hälfte (enthält etwa 105 Aminosäurereste) in der Nähe des C-Terminus der L-Kette.Jeder funktionelle Bereich der H-Kette enthält etwa 110 Aminosäurereste und einen Peptidring, der aus 50–60 Aminosäureresten besteht, die durch Disulfidbindungen verbunden sind.Die Aminosäurezusammensetzung und -anordnung dieser Region sind in der gleichen tierischen Ig-Isotyp-L-Kette und der gleichen Typ-H-Kette relativ konstant.Ebenso kann es nur spezifisch an das entsprechende Antigen binden, aber die Struktur seiner C-Region ist gleich, das heißt, es hat die gleiche Antigenität.Der sekundäre Anti-Human-IgG-Antikörper (oder Anti-Antikörper) des Pferdes kann mit den beiden kombiniert werden. Es entsteht eine Kombination von Antikörpern (IgG) gegen verschiedene Exotoxine.Dies ist eine wichtige Grundlage für die Herstellung von Sekundärantikörpern und die Anwendung von Fluorescein, Isotopen, Enzymen und anderen markierten Antikörpern.
Die konstante Region (C-Region)befindet sich bei 3/4 oder 4/5 (ungefähr von Aminosäure 119 bis zum C-Terminus) der H-Kette in der Nähe des C-Terminus und bei der Hälfte (enthält etwa 105 Aminosäurereste) in der Nähe des C-Terminus der L-Kette.Jeder funktionelle Bereich der H-Kette enthält etwa 110 Aminosäurereste und einen Peptidring, der aus 50–60 Aminosäureresten besteht, die durch Disulfidbindungen verbunden sind.Die Aminosäurezusammensetzung und -anordnung dieser Region sind in der gleichen tierischen Ig-Isotyp-L-Kette und der gleichen Typ-H-Kette relativ konstant.Ebenso kann es nur spezifisch an das entsprechende Antigen binden, aber die Struktur seiner C-Region ist gleich, das heißt, es hat die gleiche Antigenität.Der sekundäre Anti-Human-IgG-Antikörper (oder Anti-Antikörper) des Pferdes kann mit den beiden kombiniert werden. Es entsteht eine Kombination von Antikörpern (IgG) gegen verschiedene Exotoxine.Dies ist eine wichtige Grundlage für die Herstellung von Sekundärantikörpern und die Anwendung von Fluorescein, Isotopen, Enzymen und anderen markierten Antikörpern.
Verwandte Produkte:
Cell Direct RT-qPCR-Kit
Zeitpunkt der Veröffentlichung: 30. September 2021








